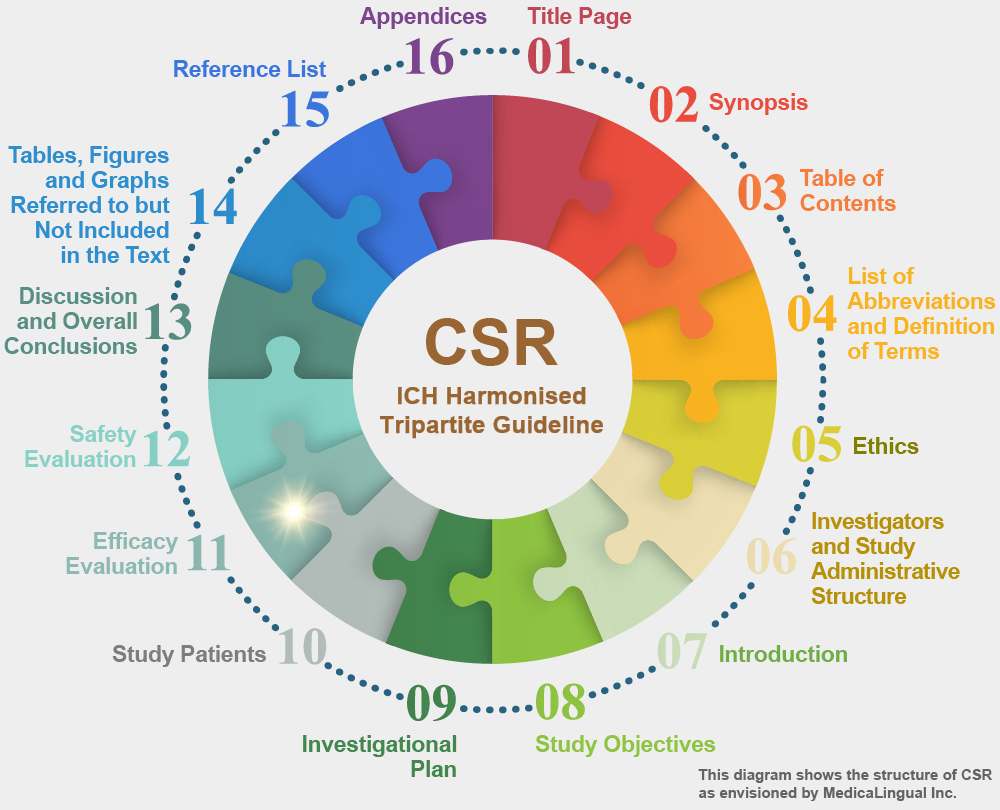
治験の統括報告書の構成と内容に関するガイドライン
平成8年5月1日 薬審第335号
各都道府県衛生主管部(局)長あて 厚生省薬務局審査課長通知
STRUCTURE AND CONTENT OF CLINICAL STUDY REPORTS
Recommended for Adoption at Step 4 of the ICH Process on 30 November 1995 by the ICH Steering Committee
11. 有効性の評価
11.4 有効性に関する成績及び個別患者データ一覧表
11.4.3 個別反応データの作表
群の特性を示す表及び図に加えて,個別反応データ及び他の重要な治験に関する情報を表で示すこと。報告書の中に何を含めるべきかは,試験によって,また薬効群によって異なる。申請者は,可能であれば審査当局に相談してから,何を総括報告書の付録に含めるかを決めなければならない。何が報告書の付録に含まれているか,そして審査当局から要求された場合,何が要求に応じて利用可能であるかを報告書の中で示すこと。
11. EFFICACY EVALUATION
11.4 EFFICACY RESULTS AND TABULATIONS OF INDIVIDUAL PATIENT DATA
11.4.3 TABULATION OF INDIVIDUAL RESPONSE DATA
In addition to tables and graphs representing group data, individual response data and other relevant study information should be presented in tables. Some regulatory authorities may require all individual data in archival case report tabulations. What needs to be included in the report will vary from study to study and from one drug class to another and the applicant must decide, if possible after consultation with the regulatory authority, what to include in appendix to the study report. The study report should indicate what material is included as an appendix, what is in the more extensive archival case report tabulations, if required by the regulatory authority, and what is available on request.
主要な有効性の測定又は評価(例えば,血液や尿の培養,肺機能検査,不整脈の頻度,全般的評価)が間隔をおいて繰り返される比較対照試験においては,報告書に添付されるデータ一覧表中に,個々の患者ごとに,患者の識別コード,基準値を含む主要な項目の全ての測定値又は観察値を含めること。これには,それらがいつ測定されたか(例えば,適切なら,治療開始後の日数及びその日の時刻),その時の薬剤・用量(役立つならmg/kgで表す),遵守状況の評価,及び測定若しくは評価時又はその近辺での併用療法も含めること。繰返し評価とは別に,反応例か非反応例かについての何らかの全般的評価(細菌学的に治癒か無効かなど)が含まれているなら,それも表に含めること。
For a controlled study in which critical efficacy measurements or assessments (e.g., blood or urine cultures, pulmonary function tests, angina frequency, or global evaluations) are repeated at intervals, the data listings accompanying the report should include, for each patient, a patient identifier, all measured or observed values of critical measurements, including baseline measurements, with notation of the time during the study (e.g., days on therapy and time of day, if relevant) when the measurements were made, the drug/dose at the time (if useful, given as mg/kg), any measurements of compliance, and any concomitant medications at the time of, or close to the time of, measurement or assessment. If, aside from repeated assessments, the study included some overall responder vs non-responder evaluation(s), (bacteriologic cure or failure), it should also be included.
主要測定値に加えて,表には,患者が有効性評価に採用されているかどうか(もし複数あるなら,どの評価に含まれるか)及び患者の服薬遵守に関する情報(収集した場合)を提示し,報告書に含まれている症例記録があるならば,その所在を明示すること。年齢,性,体重,治療された疾患(対象疾患が複数の試験の場合),及び疾患の病期又は重症度などの主要な基準値情報も有用である。主要な測定項目の基準値は,通常,それぞれの有効性測定の初期値として含まれる。
In addition to critical measurements, the tabulation should note whether the patient was included in the efficacy evaluation (and which evaluation, if more than one), provide patient compliance information, if collected, and a reference to the location of the case report form, if included. Critical baseline information such as age, sex, weight, disease being treated (if more than one in study), and disease stage or severity, is also helpful. The baseline values for critical measurements would ordinarily be included as zero time values for each efficacy measurement.
より広範囲の症例一覧表よりはむしろ,ここで述べる一覧表を総括報告書の付録16.2.6に含めること。なぜならば,この一覧表は統合された要約を裏付ける有効性のデータを示すからである。そのような詳細な表は審査の目的のためにはかさばる傾向があるが,より的を絞り込んだ表示の工夫が期待される。例えば,報告された測定値が多数あるなら,それぞれの患者の最も重要な測定値(例えば,ある来院時点の血圧値が他の値より重要なことがあるかもしれない)の一覧表として,1行か数行で要約した各々の患者の反応を示すことにより,治験における個々の患者の結果が概観できる。
The tabulation described should usually be included in appendix 16.2.6 of the study report, rather than in the more extensive case report tabulations required by some regulatory authorities, because it represents the basic efficacy data supporting summary tables. Such a thorough tabulation can be unwieldy for review purposes, however, and it is expected that more targeted displays will be developed as well. For example, if there are many measurements reported, tabulations of the most critical measurements for each patient (e.g., the blood pressure value at certain visits might be more important than others) will be useful in providing an overview of each individual’s results in a study, with each patient’s response summarised on a single line or small number of lines.
ガイドライン ― Q&A
統計的推定の重視
Q16:症例一覧表には2つの形式があるという理解でよいか
A16:一つの症例の情報をコンパクトに集めた形式(いわば症例記録の要約)と,複数の症例の情報を作表した形式(例えば,項目を横に,症例を縦に並べた表)の2通りの表があり,どの一覧表にどの形式を用いるべきかはガイドライン本文に示されている。
***










