メディカルライターと翻訳者のためのCTDガイドライン
― 医薬審発第899号 CTD通知(別紙 3, 4, 5)
注意事項:当サイトに掲載されたガイドラインは、メディカルライターや翻訳者の方々の参考用又は学習用に、PMDA情報提供ホームページから日英併記で引用したものです。レイアウトの都合上、省略した箇所もありますので、各ガイドラインの完全な情報については、必ずPMDA情報提供ホームページから取得してください。
CTD Guidelines for Medical Writers and Translators
― ICH Guidelines for M4Q, M4S, M4E
Note: The guidelines on this website are quoted from the PMDA’s information website in both Japanese and English for the reference and study purposes of medical writers and translators. Some parts have been omitted due to the layout, so please be sure to obtain complete information on each guideline from the PMDA’s information website.
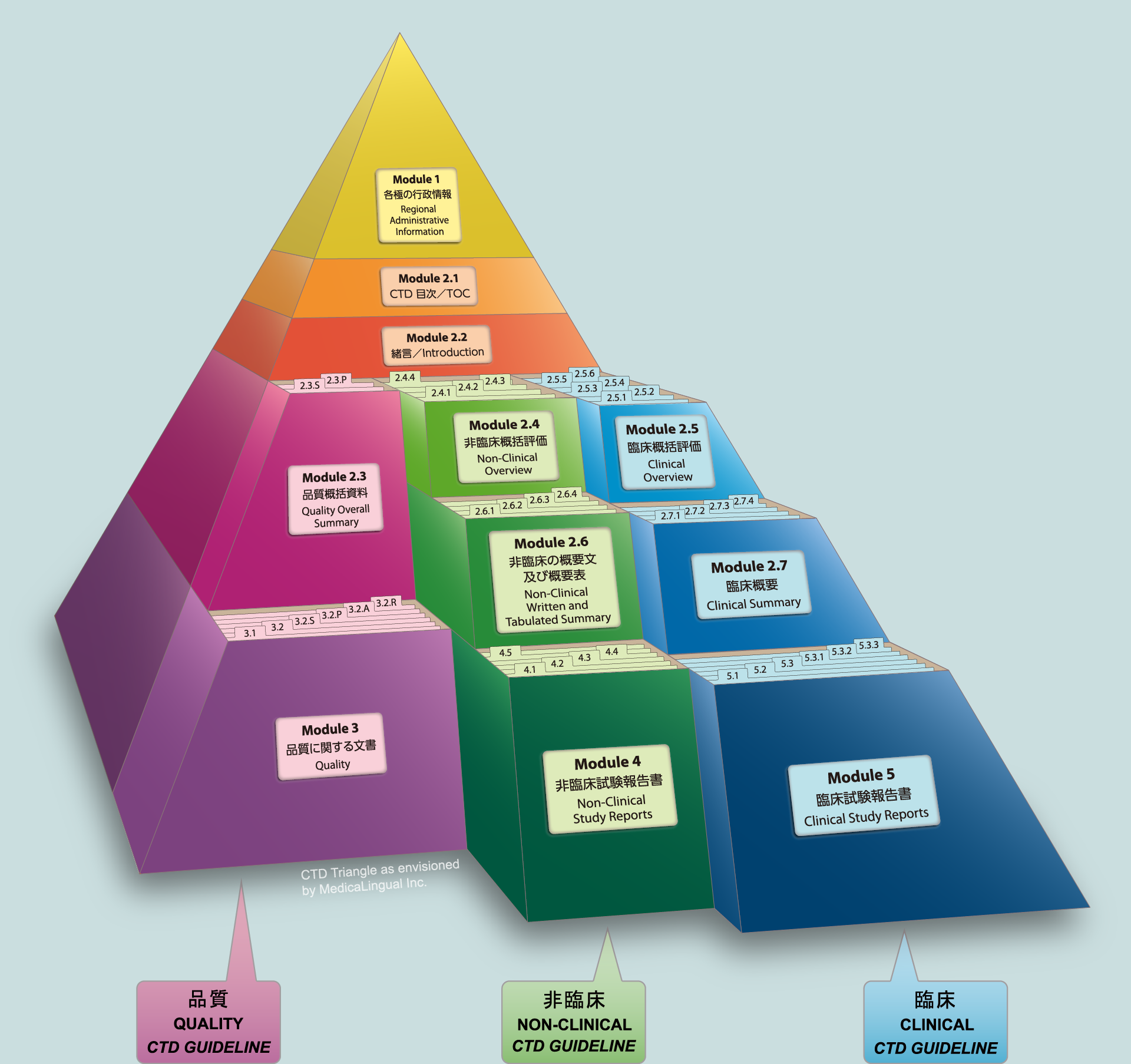
■ Module 2.3 品質に関する概括資料/QUALITY OVERALL SUMMARY (QOS)
2.3.S.1 一般情報/General Information
2.3.S.4 原薬の管理/Control of Drug Substance
2.3.S.5 標準品又は標準物質/Reference Standards or Materials
2.3.S.6 容器及び施栓系/Container Closure System
2.3.P.1 製剤及び処方/Description and Composition of the Drug Product
2.3.P.2 製剤開発の経緯/Pharmaceutical Development
2.3.P.4 添加剤の管理/Control of Excipients
2.3.P.5 製剤の管理/Control of Drug Product
2.3.P.6 標準品及び標準物質/Reference Standards or Materials
2.3.P.7 容器及び施栓系/Container Closure System
2.3.A.1 製造施設及び設備/Facilities and Equipment
2.3.A.2 外来性感染性物質の安全性評価/Adventitious Agents Safety Evaluation
2.3.R 各極の要求資料/Regional Information
3.1 目次/Table of Contents of Module 3
3.2.S.1 一般情報/General Information
3.2.S.4 原薬の管理/Control of Drug Substance
3.2.S.5 標準品又は標準物質/Reference Standards or Materials
3.2.S.6 容器及び施栓系/Container Closure System
3.2.P.1 製剤及び処方/Description and Composition of the Drug Product
3.2.P.2 製剤開発の経緯/Pharmaceutical Development
3.2.P.4 添加剤の管理/Control of Excipients
3.2.P.5 製剤の管理/Control of Drug Product
3.2.P.6 標準品又は標準物質/Reference Standards or Materials
3.2.P.7 容器及び施栓系/Container Closure System
3.2.A.1 製造施設及び設備/Facilities and Equipment
3.2.A.2 外来性感染性物質の安全性評価/Adventitious Agents Safety Evaluation
■ Module 2.4 非臨床に関する概括評価/NONCLINICAL OVERVIEW
2.4.1 非臨床試験計画概略/Overview of the Nonclinical Testing Strategy
2.4.5 総括及び結論/Integrated Overview and Conclusions
■ Module 2.6 非臨床試験の概要文及び概要表/NONCLINICAL WRITTEN AND TABULATED SUMMARIES
2.6.2 薬理試験の概要文/Pharmacology Written Summary
2.6.2.2 効力を裏付ける試験/Primary Pharmacodynamics
2.6.2.3 副次的薬理試験/Secondary Pharmacodynamics
2.6.2.4 安全性薬理試験/Safety Pharmacology
2.6.2.5 薬力学的薬物相互作用試験/Pharmacodynamic Drug Interactions
2.6.2.6 考察及び結論/Discussion and Conclusions
2.6.3 薬理試験概要表/Pharmacology Tabulated Summary
2.6.4 薬物動態試験の概要文/Pharmacokinetics Written Summary
2.6.4.2 分析法/Methods of Analysis
2.6.4.5 代謝(動物種間の比較)/Metabolism (interspecies comparison)
2.6.4.7 薬物動態学的薬物相互作用/Pharmacokinetic Drug Interactions
2.6.4.8 その他の薬物動態試験/Other Pharmacokinetic Studies
2.6.4.9 考察及び結論/Discussion and Conclusions
2.6.4.10 図表/Tables and Figures
2.6.5 薬物動態試験概要表/Pharmacokinetics Tabulated Summary
2.6.6 毒性試験の概要文/Toxicology Written Summary
2.6.6.2 単回投与毒性試験/Single-Dose Toxicity
2.6.6.5 がん原性試験(トキシコキネティクス評価を含む)/Carcinogenicity (including supportive toxicokinetics evaluations)
2.6.6.7 局所刺激性試験/Local Tolerance
2.6.6.8 その他の毒性試験(実施している場合)/Other Toxicity Studies (if available)
2.6.6.9 考察及び結論/Discussion and Conclusions
2.6.6.10 図表/Tables and Figures
2.6.7 毒性試験概要表/Toxicology Tabulated Summary
■ Module 2.5 臨床に関する概括評価/CLINICAL OVERVIEW
2.5.1 製品開発の根拠/Product Development Rationale
2.5.2 生物薬剤学に関する概括評価/Overview of Biopharmaceutics
2.5.3 臨床薬理に関する概括評価/Overview of Clinical Pharmacology
2.5.4 有効性の概括評価/Overview of Efficacy
2.5.5 安全性の概括評価/Overview of Safety
2.5.6 ベネフィットとリスクに関する結論/Benefits and Risks Conclusions
2.5.6.1 治療の背景/Therapeutic Context
2.5.6.4 ベネフィット・リスク評価/Benefit-Risk Assessment
2.5.7 参考文献/Literature References
■ Module 2.7 臨床概要/CLINICAL SUMMARY
2.7.1 生物薬剤学及び関連する分析法の概要/Summary of Biopharmaceutic Studies and Associated Analytical Methods
2.7.1.1 背景及び概観/Background and Overview
2.7.1.2 個々の試験結果の要約/Summary of Results of Individual Studies
2.7.1.3 全試験を通しての結果の比較と解析/Comparison and Analyses of Results Across Studies
2.7.2 臨床薬理の概要/Summary of Clinical Pharmacology Studies
2.7.2.1 背景及び概観/Background and Overview
2.7.2.2 個々の試験結果の要約/Summary of Results of Individual Studies
2.7.2.3 全試験を通しての結果の比較と解析/Comparison and Analyses of Results Across Studies
2.7.3 臨床的有効性の概要/Summary of Clinical Efficacy
2.7.3.1 背景及び概観/Background and Overview of Clinical Efficacy
2.7.3.2 個々の試験結果の要約/Summary of Results of Individual Studies
2.7.3.3 全試験を通しての結果の比較と解析/Comparison and Analyses of Results Across Studies
2.7.3.4 推奨用法・用量に関する臨床情報の解析/Analysis of Clinical Information Relevant to Dosing Recommendations
2.7.3.5 効果の持続、耐薬性/Persistence of Efficacy and/or Tolerance Effects
2.7.4 臨床的安全性の概要/Summary of Clinical Safety
2.7.4.1 医薬品への曝露/Exposure to the Drug
2.7.4.3 臨床検査値の評価/Clinical Laboratory Evaluations
2.7.4.5 特別な患者集団及び状況下における安全性/Safety in Special Groups and Situations
2.7.4.6 市販後データ/Post-marketing Data
2.7.5 参考文献/Literature References
2.7.6 個々の試験のまとめ/Synopses of Individual Studies
■ Module 5 臨床試験報告書/CLINICAL STUDY REPORTS
5.1 目次/Table of Contents of Module 5
5.2 臨床試験一覧表/Tabular Listing of All Clinical Studies
5.3 試験報告書及び関連情報/Clinical Study Reports
5.3.1 生物薬剤学試験報告書/Reports of Biopharmaceutic Studies
5.3.3 臨床薬物動態(PK) 試験報告書/Reports of Human Pharmacokinetic (PK) Studies
5.3.4 臨床薬力学(PD) 試験報告書/Reports of Human Pharmacodynamic (PD) Studies
5.3.5 有効性及び安全性試験報告書/Reports of Efficacy and Safety Studies










