薬生薬審発0202第1号(平成29年2月2日)
ICH HARMONISED GUIDELINE- M4E(R2) – Dated 15 June 2016
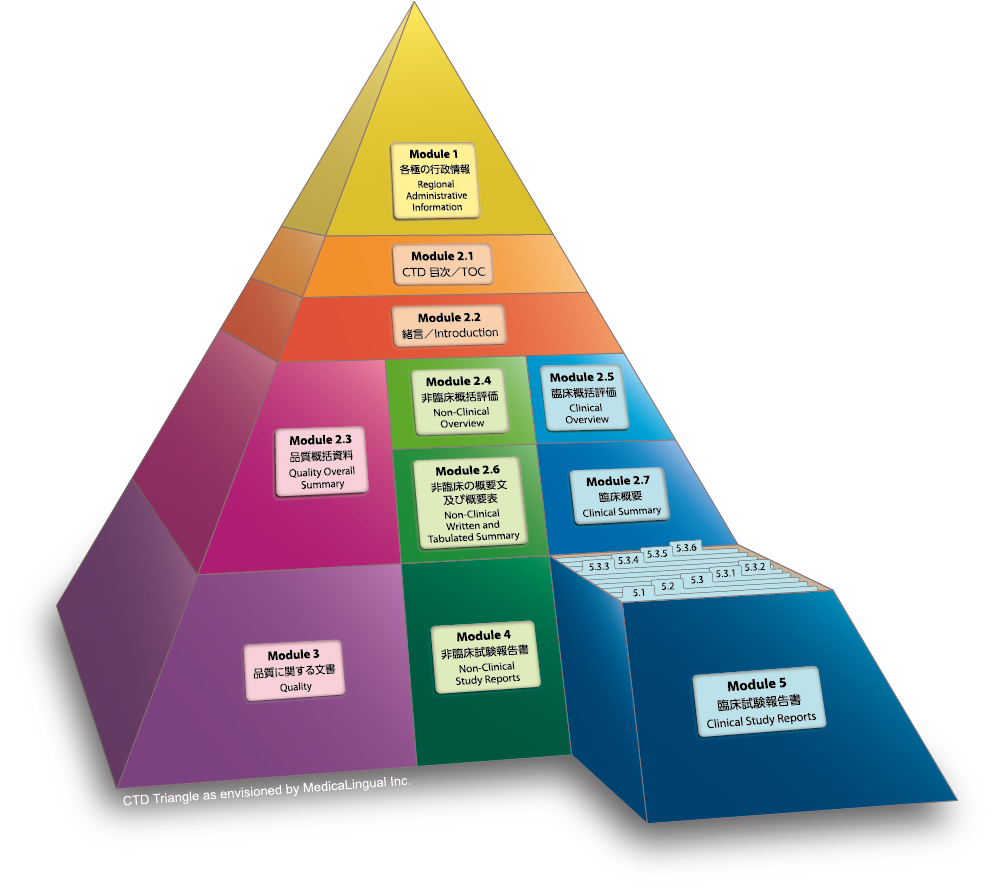
Module 5 臨床試験報告書
5.3 試験報告書及び関連情報
5.3.1 生物薬剤学試験報告書
BA 試験は、医薬品から有効成分が放出される速度と程度を評価するものである。比較 BA 試験又は BE 試験は、PK、PD、臨床的又は in vitro の溶出性等のエンドポイントを用い、単回又は反復投与で実施される。試験の主たる目的は PK の評価であるが、同時に BA 情報を得たものであれば、その結果は第 5.3.1 項に添付し、第 5.3.1.1 項、第5.3.1.2 項では第 5.3.1 項を参照すること。
Module 5 CLINICAL STUDY REPORTS
5.3 Clinical Study Reports
5.3.1 Reports of Biopharmaceutic Studies
BA studies evaluate the rate and extent of release of the active substance from the medicinal product. Comparative BA or BE studies may use PK, PD, clinical, or in vitro dissolution endpoints, and may be either single dose or multiple dose. When the primary purpose of a study is to assess the PK of a drug, but also includes BA information, the study report should be submitted in Section 5.3.1, and referenced in Sections 5.3.1.1 and/or 5.3.1.2.
5.3.1.1 バイオアベイラビリティ(BA)試験報告書
本項の BA 試験には以下の試験が含まれる。
- 経口固形製剤からの有効成分の放出及び全身的利用率を、静脈内投与又は経口液剤による全身的利用率と比較した試験
- 含量の異なる製剤間における比例性試験
- 食事の影響に関する試験
5.3.1.1 Bioavailability (BA) Study Reports
BA studies in this section should include
- studies comparing the release and systemic availability of a drug substance from a solid oral dosage form to the systemic availability of the drug substance given intravenously or as an oral liquid dosage form
- dosage form proportionality studies, and
- food-effect studies.
5.3.1.2 比較 BA 試験及び生物学的同等性(BE)試験報告書
本項に添付する試験は、有効成分放出の速度と程度を類似した製剤間(例:錠剤と錠剤、錠剤とカプセル)で比較しているものとする。比較 BA 又は BE 試験に含まれるものとしては以下の試験があげられる。
- 有効性を裏付ける試験で用いられた製剤と市販予定製剤との比較試験
- 有効性を裏付ける試験で用いられた製剤と安定性試験で用いられた製剤との比較試験
- 製造者が異なる製剤間の比較試験
5.3.1.2 Comparative BA and Bioequivalence (BE) Study Reports
Studies in this section compare the rate and extent of release of the drug substance from similar drug products (e.g., tablet to tablet, tablet to capsule). Comparative BA or BE studies may include comparisons between
- the drug product used in clinical studies supporting effectiveness and the to-be-marketed drug product,
- the drug product used in clinical studies supporting effectiveness and the drug product used in stability batches, and
- similar drug products from different manufacturers.
5.3.1.3 In Vitro-In Vivo の関連を検討した試験報告書
In vivo との関連を検討した in vitro 試験等、BA に関する情報が得られた in vitro 溶出試験があれば、この第 5.3.1.3 項に添付すること。バッチの品質管理、バッチの出庫可否判断のために用いた in vitro 溶出試験報告書は、CTD の第 3 部(モジュール 3)「品質に関する文書」に添付すること。
5.3.1.3 In Vitro – In Vivo Correlation Study Reports
In vitro dissolution studies that provide BA information, including studies used in seeking to correlate in vitro data with in vivo correlations, should be placed in Section 5.3.1.3. Reports of in vitro dissolution tests used for batch quality control and/or batch release should be placed in the Quality section of the CTD.
5.3.1.4 生物学的及び理化学的分析法検討報告書
生物薬剤学試験又は in vitro 溶出試験で用いた生物学的分析法、理化学的分析法は、通常、個々の試験報告書に記載すること。ある一つの方法が複数試験で用いられた場合は、方法及びそのバリデーションに関する報告書を第 5.3.1.4 項に添付し、個々の試験報告書においてはそれを引用すること。
5.3.1.4 Reports of Bioanalytical and Analytical Methods for Human Studies
Bioanalytical and/or analytical methods for biopharmaceutic studies or in vitro dissolution studies should ordinarily be provided in individual study reports. Where a method is used in multiple studies, the method and its validation should be included once in Section 5.3.1.4 and referenced in the appropriate individual study reports.










