医薬審発第899号 CTD通知(別紙 3)
CTD-品質に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE
QUALITY – M4Q –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
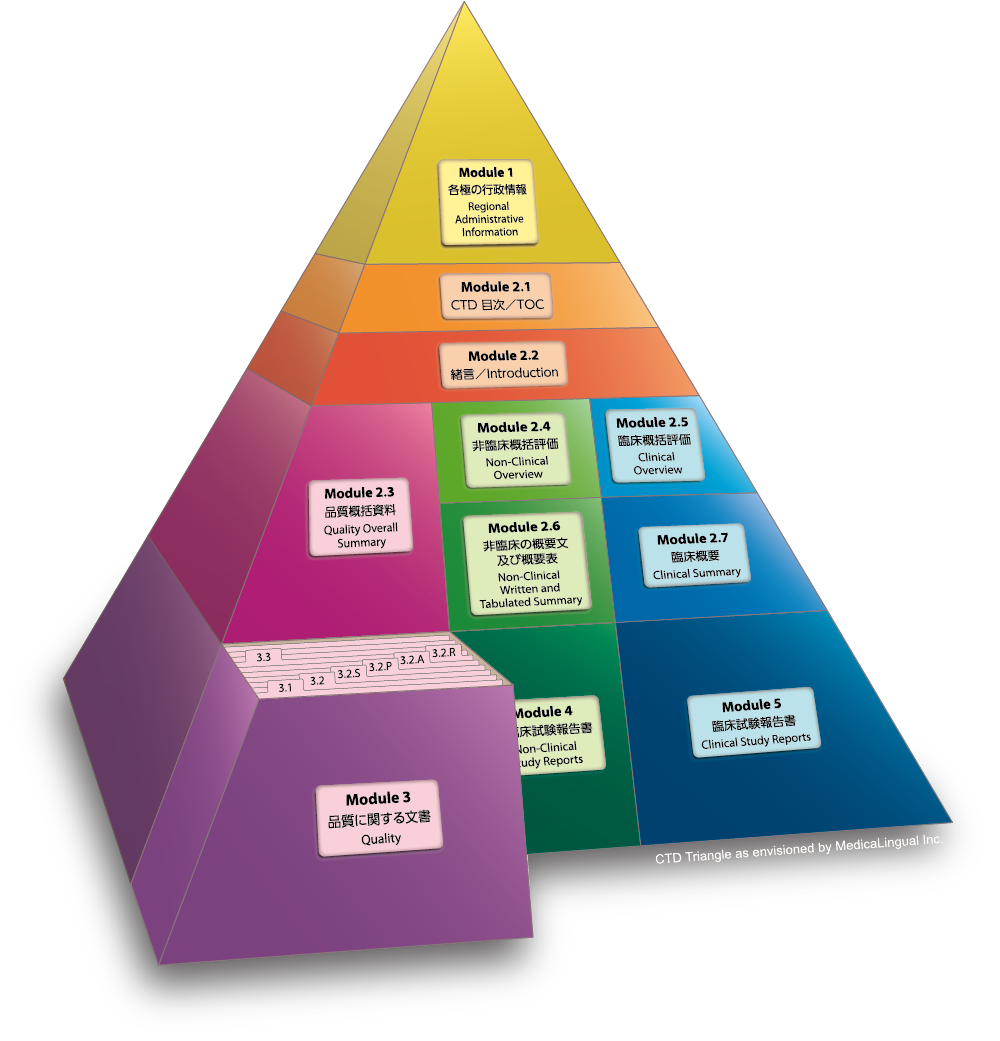
Module 3 品質に関する文書
3.2 データ
3.2.R 各極の要求資料
原薬及び製剤に関して各極に特有な追加要求資料は3.2.R 項として提出する。
詳細については、各極の関連ガイドラインを参照するか規制当局に相談すること。
本件に関係する項目としては以下のような例がある。
- バッチ・レコード(米国)
- メソッド・バリデーション・パッケージ(米国)
- コンパラビリティー・プロトコール(米国)
- 製剤のプロセス・バリデーション・スキーム(EU)
バリデーションが完了していないときは、実施しようとする試験の要約を示す。
- 医療用具(EU)
Module 3 QUALITY
3.2 Body of Data
3.2.R Regional Information
Any additional drug substance and/or drug product information specific to each region should be provided in section R of the application.
Applicants should consult the appropriate regional guidelines and/or regulatory authorities for additional guidance.
Some examples are as follows:
- Executed Batch Records (USA only)
- Method Validation Package (USA only)
- Comparability Protocols (USA only)
- Process Validation Scheme for the Drug Product (EU only)
Where validation is still to be completed, a summary of the studies intended to be conducted should be provided.
- Medical Device (EU only)










