薬生薬審発0202第1号(平成29年2月2日)
ICH HARMONISED GUIDELINE- M4E(R2) – Dated 15 June 2016
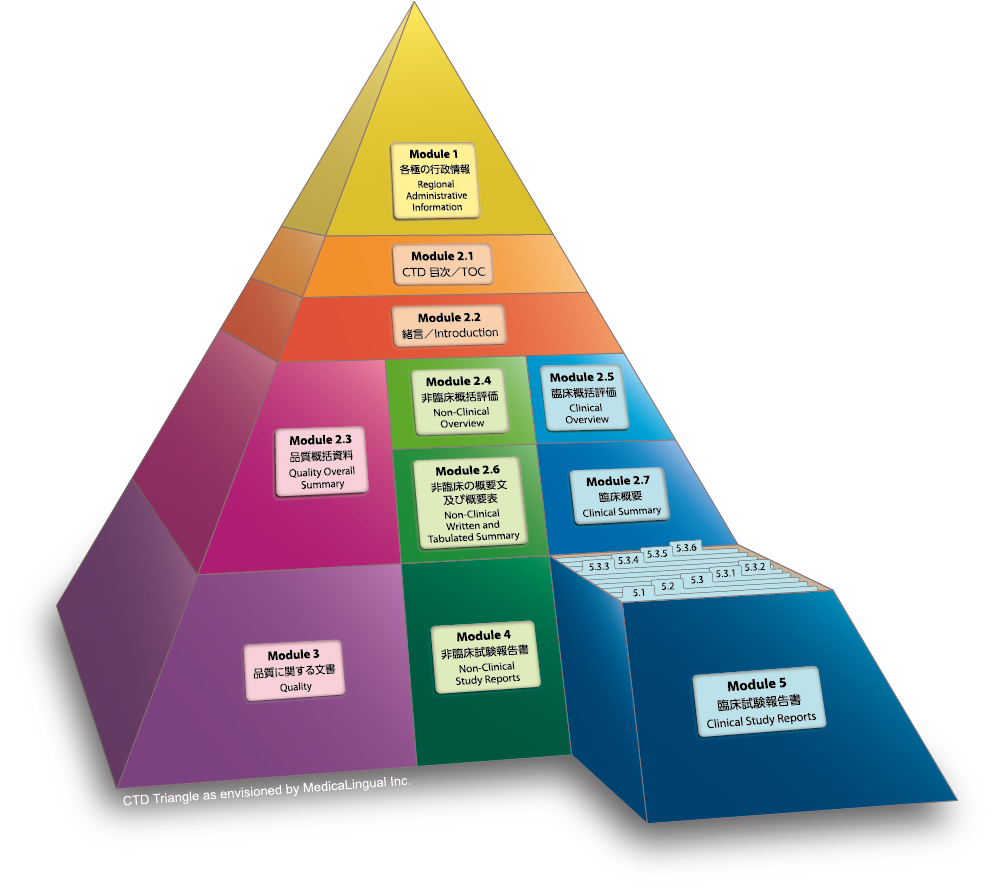
Module 5 臨床試験報告書
5.3 試験報告書及び関連情報
5.3.5 有効性及び安全性試験報告書
本項には、申請医薬品の有効性、安全性に関する全ての臨床試験報告書を添付すること。対象となるのは、治験依頼者が実施した試験か入手可能な報告書であり、申請適応症であるか否かを問わず、完了しているか進行中であるかを問わない。報告書の詳細さは、その試験の重要性及び申請における位置付けに相応したものであること。安全性と有効性の両方を裏付ける試験の報告書の内容についてはICH E3に記述されている。試験によっては、簡略化された報告書を提出してもよい(ICH E3及び地域ごとのガイダンスを参照)。
Module 5 CLINICAL STUDY REPORTS
5.3 Clinical Study Reports
5.3.5 Reports of Efficacy and Safety Studies
This section should include reports of all clinical studies of efficacy and/or safety carried out with the drug, conducted by the sponsor, or otherwise available, including all completed and all ongoing studies of the drug in proposed and non-proposed indications. The study reports should provide the level of detail appropriate to the study and its role in the application. ICH E3 describes the contents of a full report for a study contributing evidence pertinent to both safety and efficacy. Abbreviated reports can be provided for some studies (see ICH E3 and individual guidance by region).
本項における配列は、試験のデザイン(比較対照試験、非対照試験)に拠ること。また比較対照試験の配列は、対照の種類に拠ること。さらに各項では、総括報告書と簡略化された報告書(ICH E3)とに分け、総括報告書を先に添付すること。データが限られているか、又は追加データが入手できない公表文献は、最後に添付すること。
Within Section 5.3.5, studies should be organised by design (controlled, uncontrolled) and, within controlled studies, by type of control. Within each section, studies should be categorized further, ordered by whether the study report is complete or abbreviated (ICH E3), with completely reported studies presented first. Published reports with limited or no further data available to the sponsor should be placed last in this section.
複数の適応症を申請する場合には、適応症ごとに第5.3.5項を起こし、該当する報告書を分けて添付すること。ある有効性試験がひとつの適応症のみと関連している場合は、該当する適応症の第5.3.5項に添付すること。複数の適応症と関連している場合は、最も適切と考えられる適応症の第5.3.5項に添付し、必要に応じて他の適応症の第5.3.5項(例:第 5.3.5 肺炎、第 5.3.5 尿路感染症)においてはそれを参照すること。
In cases where the application includes multiple therapeutic indications, the reports should be organized in a separate Section 5.3.5 for each indication. In such cases, if a clinical efficacy study is relevant to only one of the indications included in the application, it should be included in the appropriate Section 5.3.5; if a clinical efficacy study is relevant to multiple indications, the study report should be included in the most appropriate Section 5.3.5 and referenced as necessary in other Sections 5.3.5, e.g., Section 5.3.5A, Section 5.3.5B.
5.3.5.1 申請する適応症に関する比較対照試験報告書
比較対照試験報告書は、対照の種類により配列すること。
- プラセボ対照(実対照薬や他の用量等プラセボ以外の対照を同時に比較していてもよい)
- 無治療対照
- 用量反応対照(プラセボ対照なし)
- 実薬対照(プラセボ対照なし)
- 外部(既存)対照(対照治療にかかわらず)
5.3.5.1 Study Reports of Controlled Clinical Studies Pertinent to the Claimed Indication
The controlled clinical study reports should be sequenced by type of control:
- Placebo control (could include other control groups, such as an active comparator or other doses)
- No-treatment control
- Dose-response (without placebo)
- Active control (without placebo)
- External (Historical) control, regardless of the control treatment
薬剤の有効性評価と関連がある場合には、対照の種類別に、試験を投与期間ごとに添付すること。申請した適応症に関する試験ではないが、申請した用法・用量での有効性を裏付けるデータを提供する試験は、第5.3.5.1項に添付すること。
Within each control type, where relevant to assessment of drug effect, studies should be organized by treatment duration. Studies of indications other than the one proposed in the application, but that provide support for efficacy in the proposed use, should be included in Section 5.3.5.1.
薬力学試験が有効性を裏付ける場合には、第5.3.5.1項に添付すること。試験が実施された時期的な順序は添付する順序には関連しない。したがって、プラセボ対照比較試験は、実施された時期にかかわらず、第5.3.5.1項に添付すること。安全性に関する比較対照試験も、申請の対象ではない条件での試験も含めて、第5.3.5.1項に添付すること。
Where a pharmacodynamic study contributes to evidence of efficacy, it should be included in Section 5.3.5.1. The sequence in which studies were conducted is not considered pertinent to their presentation. Thus, placebo-controlled trials, whether early or late, should be placed in Section 5.3.5.1. Controlled safety studies, including studies in conditions that are not the subject of the application, should also be reported in Section 5.3.5.1.
5.3.5.2 非対照試験報告書
非対照試験の報告書(例:非盲検の安全性試験)は、本項に添付すること。これには承認申請の対象ではないものも含まれる。
5.3.5.2 Study Reports of Uncontrolled Clinical Studies
Study reports of uncontrolled clinical studies (e.g., reports of open label safety studies) should be included in Section 5.3.5.2. This includes studies in conditions that are not the subject of the marketing application.
5.3.5.3 複数の試験成績を併せて解析した報告書
申請に関する臨床上の問題点は、複数の試験成績を考慮した解析によって扱われることがある。そのような解析結果は、一般に臨床概要に要約されるべきであるが、解析結果を詳細に記述し提示することは、その結果を解釈する上で重要である。臨床概要に記載するには解析が詳細すぎるような場合には、それらを別の報告書としてまとめること。このような報告書は、第5.3.5.3項に添付すること。本項に含まれる報告書の例には、以下のものが含まれる。
- 全ての患者及び/又は特殊な部分集団における有効率の全体的な推定値を決定するための正式なメタアナリシス又は有効性に関する広範な探索的解析の報告書
- 安全性データベースの妥当性、有害事象発現率の推定、並びに用量、人口統計学的特性、及び併用薬といった変数に関連した安全性等を評価するための安全性に関する統合された解析の報告書
5.3.5.3 Reports of Analyses of Data from More than One Study
Many clinical issues in an application can be addressed by an analysis considering data from more than one study. The results of such an analysis should generally be summarized in the clinical summary documents, but a detailed description and presentation of the results of such analyses are considered critical to their interpretation. Where the details of the analysis are too extensive to be reported in a summary document, they should be presented in a separate report. Such reports should be placed in Section 5.3.5.3. Examples of reports that would be found in this section include: a report of a formal meta-analysis or extensive exploratory analysis of efficacy to determine an overall estimate of effect size in all patients and/or in specific subpopulations, and a report of an integrated analysis of safety that assesses such factors as the adequacy of the safety database, estimates of event rates, and safety with respect to variables such as dose, demographics, and concomitant medications.
正式なブリッジング試験、関連する他の臨床試験、他の適切な情報(例:PK及びPD情報)を考慮したブリッジングに関する詳細な解析報告書は、臨床概要に含めるには長すぎる場合には、本項に添付すること。
A report of a detailed analysis of bridging, considering formal bridging studies, other relevant clinical studies, and other appropriate information (e.g., PK and PD information), should be placed in this section if the analysis is too lengthy for inclusion in the Clinical Summary.
5.3.5.4 その他の臨床試験報告書
本項には以下の報告書が添付される。
- 申請された適応症に関連した試験の中間解析に関する報告書
- 他に報告されていない安全性に関する比較対照試験の報告書
- 申請された適応症とは関連しない比較対照試験又は非対照試験の報告書
- 第5.3.5.1項には含まれない、当該医薬品の臨床経験に関する公表文献。ただし、有効性の裏付けのために重要である場合には、第5.3.5.1項に添付すること。
- 進行中の試験に関する報告書
- 第5部の他の項に添付することが適当でないと判断された報告書(例:第2部第2.7.2.4項特別な試験)
5.3.5.4 Other Study Reports
This section can include:
- Reports of interim analyses of studies pertinent to the claimed indications
- Reports of controlled safety studies not reported elsewhere
- Reports of controlled or uncontrolled studies not related to the claimed indication
- Published reports of clinical experiences with the medicinal product that are not included in Section 5.3.5.1. However, when literature is important to the demonstration or substantiation of efficacy, it should be included in Section 5.3.5.1
- Reports of ongoing studies










