医薬審発第899号 CTD通知(別紙 3)
CTD-品質に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE
QUALITY – M4Q –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
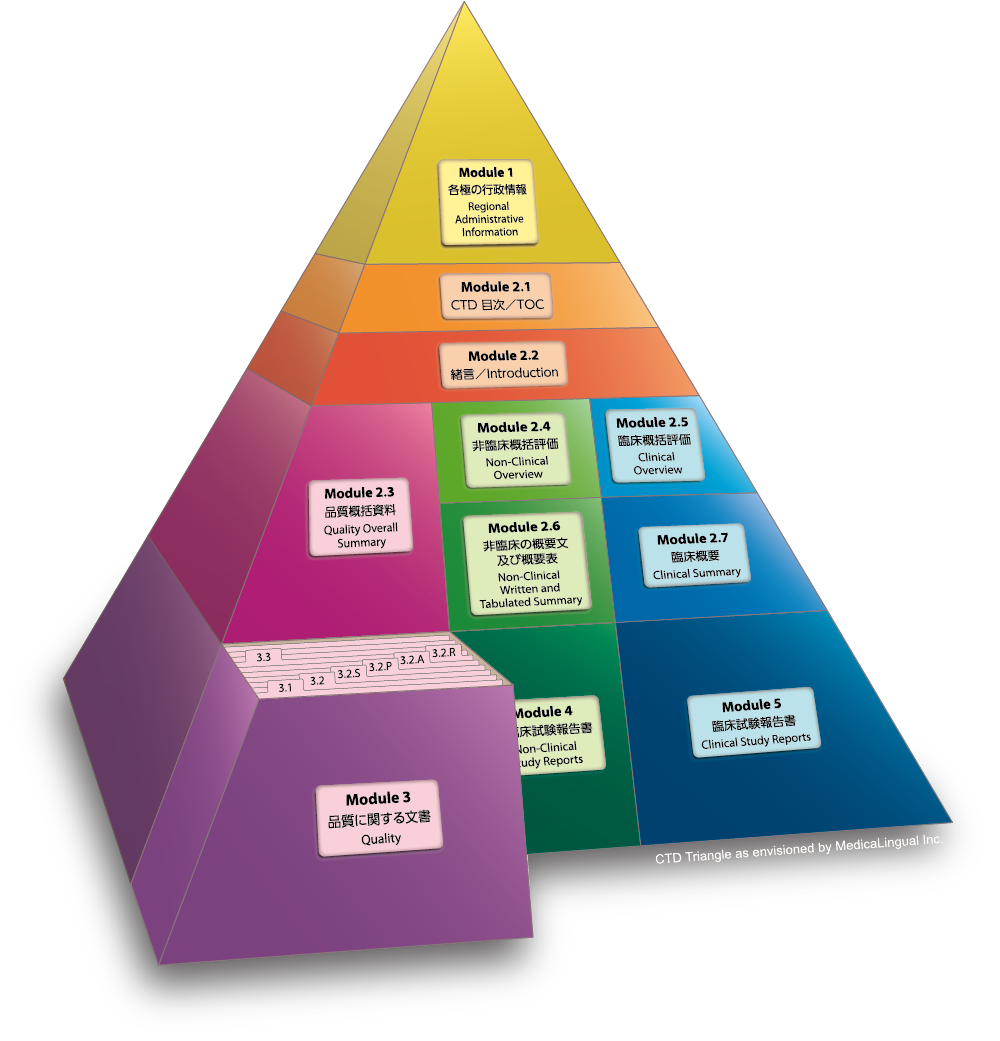
Module 3 品質に関する文書
3.2 データ
3.2.S 原薬
複数の原薬を含む製剤にあっては、各原薬ごとに3.2.S項の資料を作成する。
Module 3 QUALITY
3.2 Body of Data
3.2.S Drug Substance
For a drug product containing more than one drug substance, the information requested for part “S” should be provided in its entirety for each drug substance.
3.2.S.2 製造
3.2.S.2.1 製造業者
受託者を含むすべての製造業者の名称、住所及び分担の範囲、並びに承認を得ようとする医薬品の製造及び試験に係わるすべての事業所又は施設について記載する。
3.2.S.2 Manufacture
3.2.S.2.1 Manufacturer(s)
The name, address, and responsibility of each manufacturer, including contractors, and each proposed production site or facility involved in manufacturing and testing should be provided.
3.2.S.2.2 製造方法及びプロセス・コントロール
申請者は、原薬の製造に対して、責任を持つものであり、原薬の製造方法に関して説明する必要がある。
製造方法及びプロセス・コントロールを適切に説明するため、例えば、次のような事項を記述する。
3.2.S.2.2 Description of Manufacturing Process and Process Controls
The description of the drug substance manufacturing process represents the applicant’s commitment for the manufacture of the drug substance.
Information should be provided to adequately describe the manufacturing process and process controls. For example:
新規化学薬品:
製造工程(合成工程)の流れ図(出発物質・中間体の分子式、仕込量、収率、化学構造、試薬の分子式、仕込量、化学構造、及び原薬の分子式、収率、化学構造並びに原薬の立体化学に反映させるような事項を含む。)を示すとともに操作条件及び溶媒を明記する。
製造工程中の一連の操作手順を記述する。記述する事項は、実生産を反映する代表的なロット・スケールにおける原材料、溶媒、触媒及び試薬の量、重要工程、プロセス・コントロール、装置、操作条件(温度、圧力、pH、時間等)等である。
代替工程がある場合は、その記載も、本工程と同程度の詳細さとする。再加工を行う場合には、その工程を明らかにし、その妥当性を示す。妥当性の根拠となるデータを文献等により引用して示すか、3.2.S.2.5 において添付資料として示す。
NCE:
A flow diagram of the synthetic process(es) should be provided that includes molecular formulae, weights, yield ranges, chemical structures of starting materials, intermediates, reagents and drug substance reflecting stereochemistry, and identifies operating conditions and solvents.
A sequential procedural narrative of the manufacturing process should be submitted. The narrative should include, for example, quantities of raw materials, solvents, catalysts and reagents reflecting the representative batch scale for commercial manufacture, identification of critical steps, process controls, equipment and operating conditions (e.g., temperature, pressure, pH, time).
Alternate processes should be explained and described with the same level of detail as the primary process. Reprocessing steps should be identified and justified. Any data to support this justification should be either referenced or filed in 3.2.S.2.5.
生物薬品:
製造工程に関する情報(通例、バンク化された細胞のバイアルの使用から始まり、細胞培養、ハーベスト、精製・修飾反応、充てん、保存及び出荷条件に至る情報)を示す。
Biotech:
Information should be provided on the manufacturing process, which typically starts with a vial(s) of the cell bank, and includes cell culture, harvest(s), purification and modification reactions, filling, storage and shipping conditions.
ロット及びスケール
ナンバリング・システム(未加工/未精製バルク又は中間体のプール及びロットのサイズ又はスケールに関する事項を含む。)を説明する。
Batch(es) and scale definition
An explanation of the batch numbering system, including information regarding any pooling of harvests or intermediates and batch size or scale should be provided.
細胞培養及びハーベスト
最初の播種(例えば1本以上のワーキング・セル・バンクのアンプルに含まれる細胞等を播種する)から最後のハーベスト作業に至る製造ルートのフローチャートを示す。これにはすべての工程(すなわち、種類の異なる工程単位のすべて)及び重要中間体を示し、各工程の関連事項(例えば細胞数倍加レベル、細胞濃度、容量、pH、培養時間、保持時間、温度等)を含むこと。重要工程及び規格及び試験方法を設定した重要中間体(3.2.S.2.4 参照)を明示すること。
フローチャートに示す各工程について、スケール、培地その他添加成分(3.2.S.2.3 参照)、主な設備(詳細は3.2.A.1)及びプロセス・コントロール(工程内試験、操作管理項目、装置及び重要中間体とその規格値/判定基準(3.2.S.2.4 参照)等)を記述する。また、工程間、設備間、区画間及び建物間で材料を移送する場合には、その手順、出荷及び保存条件について記述する(保存に関する詳細は3.2.S.2.4 に記述)。
Cell culture and harvest
A flow diagram should be provided that illustrates the manufacturing route from the original inoculum (e.g. cells contained in one or more vials(s) of the Working Cell Bank up to the last harvesting operation. The diagram should include all steps (i.e., unit operations) and intermediates. Relevant information for each stage, such as population doubling levels, cell concentration, volumes, pH, cultivation times, holding times, and temperature, should be included. Critical steps and critical intermediates for which specifications are established (as mentioned in 3.2.S.2.4) should be identified.
A description of each process step in the flow diagram should be provided. Information should be included on, for example, scale; culture media and other additives (details provided in 3.2.S.2.3); major equipment (details provided in 3.2.A.1); and process controls, including in-process tests and operational parameters, process steps, equipment and intermediates with acceptance criteria (details provided in 3.2.S.2.4). Information on procedures used to transfer material between steps, equipment, areas, and buildings, as appropriate, and shipping and storage conditions should be provided.
(Details on shipping and storage provided in 3.2.S.2.4.)
精製工程及び修飾反応
ハーベストから原薬の充てんの前までの精製工程(種類の異なる工程単位)をフローチャートで示す。これにはすべての工程及び重要中間体並びに各工程の関連事項(例えば容量、pH、重要な操作/工程の処理時間、保持時間、温度、溶出プロファイル、画分の選定、中間体の保存等の該当する事項)を含むこと。規格及び試験方法を設定した重要工程及び重要中間体(3.2.S.2.4 参照)を明示すること。
フローチャートに示す各工程について、スケール、緩衝液その他の試薬類(3.2.S.2.3 参照)、主な設備(詳細は3.2.A.1 )及び資材について記述する。また、工程間、設備間、区画間及び建物間で材料を移送する場合には、その手順、出荷及び保存条件について記述する(関連事項は3.2.S.2.4 に記述)。膜、クロマトグラフィー用樹脂のような資材については、使用条件及び再使用条件に関する事項を含む(設備の詳細は3.2.A.1 参照、カラム及び膜の再使用及び再生に関するバリデーション試験については3.2.S.2.5 に関連事項記載)。また、規格値/判定基準を含むプロセス・コントロール(工程内試験及び操作管理項目を含む。)を製造工程、設備及び重要中間体とともに記述する(関連事項は3.2.S.2.4 に記載)。
再加工を実施する工程について、対象とするすべての中間体又は原薬の再加工に関する基準とともに記述する(関連事項は3.2.S.2.5 に記載)。また、工程間、設備間、区画間及び建物間で材料を移送する場合には、その手順、出荷及び保存条件について記述する(関連事項は3.2.S.2.4 に記述)。
Purification and modification reactions
A flow diagram should be provided that illustrates the purification steps (i.e., unit operations) from the crude harvest(s) up to the step preceding filling of the drug substance. All steps and intermediates and relevant information for each stage (e.g., volumes, pH, critical processing time, holding times, temperatures and elution profiles and selection of fraction, storage of intermediate, if applicable) should be included. Critical steps for which specifications are established as mentioned in 3.2.S.2.4 should be identified.
A description of each process step (as identified in the flow diagram) should be provided. The description should include information on, for example, scale, buffers and other reagents (details provided in 3.2.S.2.3, major equipment (details provided in 3.2.A.1), and materials. For materials such as membranes and chromatography resins, information for conditions of use and reuse also should be provided. (Equipment details in 3.2.A.1; validation studies for the reuse and regeneration of columns and membranes in 3.2.S.2.5.) The description should include process controls (including inprocess tests and operational parameters) with acceptance criteria for process steps, equipment and intermediates. (Details in 3.2.S.2.4.)
Reprocessing procedures with criteria for reprocessing of any intermediate or the drug substance should be described. (Details should be given in 3.2.S.2.5.) Information on procedures used to transfer material between steps, equipment, areas, and buildings, as appropriate, and shipping and storage conditions should be provided (details on shipping and storage provided in 3.2.S.2.4.).
充てん、保存、移送(出荷)
原薬の充てん方法、プロセス・コントロール(工程内試験及び操作管理項目を含む。)及び規格/判定基準を記述する(関連事項は3.2.S.2.4 に記述)。原薬を保存する容器及び施栓系(詳細は3.2.S.6 に記述) 並びに原薬の保存、移送(出荷)の条件を記述する。
参照ICHガイドラインQ5A、Q5B及びQ6B
Filling, storage and transportation (shipping)
A description of the filling procedure for the drug substance, process controls (including in-process tests and operational parameters), and acceptance criteria should be provided. (Details in 3.2.S.2.4.) The container closure system(s) used for storage of the drug substance (details in 3.2.S.6.) and storage and shipping conditions for the drug substance should be described.
Reference ICH Guidelines: Q5A, Q5B, and Q6B
3.2.S.2.3 原材料の管理
原薬の製造に使用される原材料(原料、出発物質、溶媒、試薬、触媒等)について、当該原材料の使用される工程を明らかにしたうえで一覧表を作成する。これらの原材料の品質及び管理について記述する。原材料(培地成分、モノクローナル抗体、酵素等の生物起源の原材料を含む。)がその使用目的に応じた規格に適合していることを裏付ける資料(外来性因子のクリアランス又は管理を含む。)を必要に応じて示す。生物起源の原材料については、その起源、製造及び特性に関する資料を含める(詳細は3.2.A.2 に記述)。
参照ICHガイドラインQ6A及びQ6B
3.2.S.2.3 Control of Materials
Materials used in the manufacture of the drug substance (e.g., raw materials, starting materials, solvents, reagents, catalysts) should be listed identifying where each material is used in the process. Information on the quality and control of these materials should be provided. Information demonstrating that materials (including biologically-sourced materials, e.g., media components, monoclonal antibodies, enzymes) meet standards appropriate for their intended use (including the clearance or control of adventitious agents) should be provided, as appropriate. For biologically-sourced materials, this can include information regarding the source, manufacture, and characterisation. (Details in 3.2.A.2 for both NCE and Biotech)
Reference ICH Guidelines: Q6A and Q6B
生物薬品:
生物起源の原材料及び出発物質の管理
生物起源の原材料に関する外来性因子の安全性評価の要約を記述する(詳細は3.2.A.2に記述)。
細胞基材の起源、履歴及び作製
細胞基材の起源、遺伝子組換え細胞の遺伝子発現構成体の解析及びマスター・セル・バンクの作製に用いたクローン細胞について、Q5B及びQ5Dに基づいて記述する。
セル・バンクシステム、特性解析及び試験方法
セル・バンクシステム、品質管理法並びに製造及び保存中(マスター・セル・バンク及びワーキング・セル・バンクの作製手順を含む。)の細胞株の安定性について、Q5B及びQ5Dに基づいて記述する。
参照ICHガイドラインQ5A、Q5B、Q5C及びQ5D
Biotech:
Control of Source and Starting Materials of Biological Origin
Summaries of viral safety information for biologically-sourced materials should be provided. (Details in 3.2.A.2.)
Source, history, and generation of the cell substrate
Information on the source of the cell substrate and analysis of the expression construct used to genetically modify cells and incorporated in the initial cell clone used to develop the Master Cell Bank should be provided as described in Q5B and Q5D.
Cell banking system, characterisation, and testing
Information on the cell banking system, quality control activities, and cell line stability during production and storage (including procedures used to generate the Master and Working Cell Bank(s)) should be provided as described in Q5B and Q5D.
Reference ICH Guidelines: Q5A, Q5B, Q5C and Q5D
3.2.S.2.4 重要工程及び重要中間体の管理
重要工程:製造工程のうち3.2.S.2.2 で示された重要工程において工程が管理されていることを保証するために実施される試験方法及び規格値/判定基準(その設定根拠となる試験データを含む。)を記述する。
重要中間体:製造工程中で単離される中間体の品質及び管理方法を記述する。
参照ICHガイドラインQ6A及びQ6B
生物薬品に関する追加項目:重要中間体の保存条件の妥当性を裏付ける安定性試験成績を示す。
参照ICHガイドラインQ5C
3.2.S.2.4 Controls of Critical Steps and Intermediates
Critical Steps: Tests and acceptance criteria (with justification including experimental data) performed at critical steps identified in 3.2.S.2.2 of the manufacturing process to ensure that the process is controlled should be provided.
Intermediates: Information on the quality and control of intermediates isolated during the process should be provided.
Reference ICH Guidelines: Q6A and Q6B
Additionally for Biotech: Stability data supporting storage conditions should be provided.
Reference ICH Guideline: Q5C
3.2.S.2.5 プロセス・バリデーション/プロセス評価
無菌工程及び滅菌工程のプロセス・バリデーションやプロセス評価について記述する。
生物薬品:
製造工程(再加工を行う工程を含む。)が目的に適しているかどうかを証明し、重要なプロセス・コントロール法(操作管理項目及び工程内管理試験)を選択し、重要な製造工程(細胞培養、ハーベスト、精製、修飾等)における判定基準の妥当性を実証するためのバリデーション及び評価試験に関する十分な資料を示す。
試験計画並びに試験の結果、考察及び結論を記述する。試験方法とそのバリデーションについては、相互参照できるようにする(例えば3.2.S.2.4 と3.2.S.4.3 などのごとく)か、又は重要なプロセス・コントロール法の選択及び規格値/判定基準の妥当性を示す資料の一部として記述する。
ウイルス汚染を除去又は不活化する製造工程について、ウイルスクリアランス評価試験に関する資料を3.2.A.2 にて示すこと。
3.2.S.2.5 Process Validation and/or Evaluation
Process validation and/or evaluation studies for aseptic processing and sterilisation should be included.
Biotech:
Sufficient information should be provided on validation and evaluation studies to demonstrate that the manufacturing process (including reprocessing steps) is suitable for its intended purpose and to substantiate selection of critical process controls (operational parameters and in-process tests) and their limits for critical manufacturing steps (e.g., cell culture, harvesting, purification, and modification).
The plan for conducting the study should be described and the results, analysis and conclusions from the executed study(ies) should be provided. The analytical procedures and corresponding validation should be cross-referenced (e.g., 3.2.S.2.4, 3.2.S.4.3) or provided as part of justifying the selection of critical process controls and acceptance criteria.
For manufacturing steps intended to remove or inactivate viral contaminants, the information from evaluation studies should be provided in 3.2.A.2.
3.2.S.2.6 製造工程の開発の経緯
新規化学薬品:
非臨床試験や臨床試験用のロット、スケール・アップ検討時のロット、パイロット・スケール及び実生産規模(もしあれば)のロットにおいて原薬の製造工程及び製造場所に重大な変更があったときは、変更内容の説明及び考察を記述する。
3.2.S.4.4 に示された原薬のロット分析データを参照すること。
参照ICHガイドラインQ3A
3.2.S.2.6 Manufacturing Process Development
NCE:
A description and discussion should be provided of the significant changes made to the manufacturing process and/or manufacturing site of the drug substance used in producing nonclinical, clinical, scale-up, pilot, and, if available, production scale batches.
Reference should be made to the drug substance data provided in section 3.2.S.4.4.
Reference ICH Guideline: Q3A
生物薬品:
3.2.S.2.2 記載の製造工程の開発の経緯を記述する。承認申請資料(非臨床試験、臨床試験等)に用いられた原薬ロットにおいて製造方法の変更がなされたときは、変更内容(例:製造工程、重要な設備等)について記述し、その理由を説明すること。また、変更に関連して、開発中に製造された原薬ロットに関する事項(ロット番号、製造スケール、使途(例:安定性試験、非臨床試験、標準物質)等)を記述する。重大な変更かどうかは、当該変更が原薬の品質(場合によっては、重要中間体の品質も含む。)にどれほど影響しうるかを評価して判断する。重大な変更と考えられるときは、当該変更の原薬の品質に対する影響の程度を判定するために、変更前後の原薬ロットを比較する試験データを提出すること(詳細はQ6Bを参照)。試験方法の選択及び試験データの妥当性を示し、結果を考察する。
製造方法の変更が原薬及びその製剤の品質に与える影響を評価するロットの比較試験には非臨床・臨床試験のロットのデータも含まれることがある。その場合には、他のモジュールに記載されているこれらの試験成績を相互参照すること。
3.2.S.4.4 に示された原薬のロット分析データを参照すること。
参照ICHガイドラインQ6B
Biotech:
The developmental history of the manufacturing process, as described in 3.2.S.2.2, should be provided. The description of change(s) made to the manufacture of drug substance batches used in support of the marketing application (e.g., nonclinical or clinical studies) should include, for example, changes to the process or to critical equipment. The reason for the change should be explained. Relevant information on drug substance batches manufactured during development, such as the batch number, manufacturing scale, and use (e.g., stability, nonclinical, reference material) in relation to the change, should be provided. The significance of the change should be assessed by evaluating its potential to impact the quality of the drug substance (and/or intermediate, if appropriate). For manufacturing changes that are considered significant, data from comparative analytical testing on relevant drug substance batches should be provided to determine the impact on quality of the drug substance (see Q6B for additional guidance). A discussion of the data, including a justification for selection of the tests and assessment of results, should be included.
Testing used to assess the impact of manufacturing changes on the drug substance(s) and the corresponding drug product(s) can also include nonclinical and clinical studies. Cross-reference to the location of these studies in other modules of the submission should be included.
Reference should be made to the drug substance data provided in section 3.2.S.4.4.
Reference ICH Guideline: Q6B










