医薬審発第899号 CTD通知(別紙 3)
CTD-品質に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE
QUALITY – M4Q –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
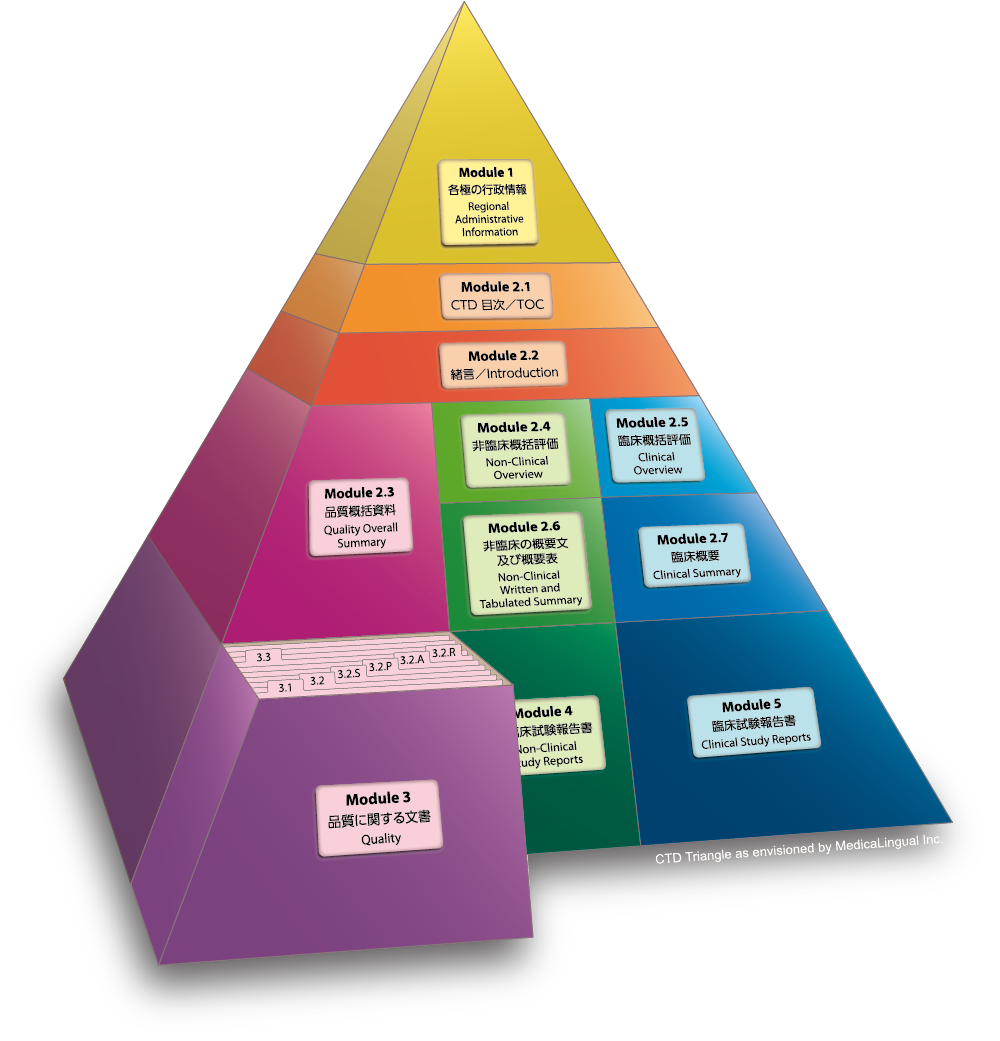
Module 3 品質に関する文書
3.2 データ
3.2.P 製剤
3.2.P.2 製剤開発の経緯
製剤開発の経緯の項には、剤型、製剤設計・処方、製造工程、容器及び施栓系、微生物学的観点から見た特徴及び使用方法等が、使用目的に叶うことを裏付けるために実施された開発段階での検討について記述する。本項に記述する試験は、規格及び試験方法に基づいて実施する品質管理のためのルーチン試験とは区別すべきものである。更に、再現性のあるロット生産、製剤機能、製剤の品質に影響すると考えられる製剤設計、処方、製剤化工程の特徴的指標(重要なパラメータ)について明らかにし、説明すること。個別に実施した試験又は文献から得られた裏付けデータや結果は本項に含めるか、別添とする。(製剤機能に関する)追加データについては、申請資料の非臨床又は臨床の項を参照してもよい。
参照ICHガイドラインQ6A及びQ6B
Module 3 QUALITY
3.2 Body of Data
3.2.P Drug Product
3.2.P.2 Pharmaceutical Development
The Pharmaceutical Development section should contain information on the development studies conducted to establish that the dosage form, the formulation, manufacturing process, container closure system, microbiological attributes and usage instructions are appropriate for the purpose specified in the application. The studies described here are distinguished from routine control tests conducted according to specifications. Additionally, this section should identify and describe the formulation and process attributes (critical parameters) that can influence batch reproducibility, product performance and drug product quality. Supportive data and results from specific studies or published literature can be included within or attached to the Pharmaceutical Development section. Additional supportive data can be referenced to the relevant nonclinical or clinical sections of the application.
Reference ICH Guidelines: Q6A and Q6B
3.2.P.2.1 製剤成分
3.2.P.2.1.1 原薬
原薬と3.2.P.1 に記載の添加剤との配合適性を考察する。製剤機能に影響する可能性がある原薬の重要な物理的化学的性質(水分含量、溶解性、粒度分布、結晶多形、固体状態での存在形等)を記載し、考察する。複数の原薬を含む製剤(配合剤等)については、原薬相互の配合適性を考察する。
3.2.P.2.1 Components of the Drug Product
3.2.P.2.1.1 Drug Substance
The compatibility of the drug substance with excipients listed in 3.2.P.1 should be discussed. Additionally, key physicochemical characteristics (e.g., water content, solubility, particle size distribution, polymorphic or solid state form) of the drug substance that can influence the performance of the drug product should be discussed. For combination products, the compatibility of drug substances with each other should be discussed.
3.2.P.2.1.2 添加剤
3.2.P.1 に記載の添加剤について、その選択理由、添加量及び製剤機能に影響する可能性がある特性を各添加剤の機能と関連づけて考察する。
3.2.P.2.1.2 Excipients
The choice of excipients listed in 3.2.P.1, their concentration, their characteristics that can influence the drug product performance should be discussed relative to their respective functions.
3.2.P.2.2 製剤
3.2.P.2.2.1 製剤設計
申請する投与経路及び用法を考慮して、製剤設計の簡潔な要約を示す。臨床試験に用いられた製剤処方と3.2.P.1 に記述した製剤処方とが異なるときは、その違いについて考察する。必要に応じ、製剤の同等・同質性に係わるin vitro試験(溶出試験等)又はin vivo 試験(生物学的同等性試験等)の試験結果について考察する。
3.2.P.2.2 Drug Product
3.2.P.2.2.1 Formulation Development
A brief summary describing the development of the drug product should be provided, taking into consideration the proposed route of administration and usage. The differences between clinical formulations and the formulation (i.e. composition) described in 3.2.P.1 should be discussed. Results from comparative in vitro studies (e.g., dissolution) or comparative in vivo studies (e.g., bioequivalence) should be discussed when appropriate.
3.2.P.2.2.2 過量仕込み
3.2.P.1 に製剤処方の過量仕込みが記載されているときは、その妥当性を示す。
3.2.P.2.2.3 物理的化学的及び生物学的性質
製剤特性に関係した事項(例:pH、イオン強度、溶出特性、分散性、再調製の際の溶解性、粒度分布、凝集性、結晶多形、レオロジー特性、生物活性/力価、免疫学的性質等)について記述する。
3.2.P.2.2.2 Overages
Any overages in the formulation(s) described in 3.2.P.1 should be justified.
3.2.P.2.2.3 Physicochemical and Biological Properties
Parameters relevant to the performance of the drug product, such as pH, ionic strength, dissolution, redispersion, reconstitution, particle size distribution, aggregation, polymorphism, rheological properties, biological activity or potency, and/or immunological activity, should be addressed.
3.2.P.2.3 製造工程の開発の経緯
3.2.P.3.3 記載の製造工程の選択及び最適化について、特に重要な点を説明する。適宜、滅菌方法について説明し、その妥当性を示す。主要な臨床試験に用いたロットの製造工程と3.2.P.3.3 記載の製造工程との違いが製剤特性に影響を与えうるときは、それについて考察する。
3.2.P.2.3 Manufacturing Process Development
The selection and optimisation of the manufacturing process described in 3.2.P.3.3, in particular its critical aspects, should be explained. Where relevant, the method of sterilisation should be explained and justified. Differences between the manufacturing process(es) used to produce pivotal clinical batches and the process described in 3.2.P.3.3 that can influence the performance of the product should be discussed.
3.2.P.2.4 容器及び施栓系
製剤の保存、移送(出荷)及び使用時に用いられる容器及び施栓系の適格性(3.2.P.7 参照)について考察する。これには、素材の選択、防湿性・遮光性、構成する素材と製剤との適合性(容器への吸着・溶出を含む)、構成する素材の安全性、性能(製剤の一部として申請されている場合は容器/用具からの注出量の再現性等)等がある。
3.2.P.2.4 Container Closure System
The suitability of the container closure system (described in 3.2.P.7) used for the storage, transportation (shipping) and use of the drug product should be discussed. This discussion should consider, e.g., choice of materials, protection from moisture and light, compatibility of the materials of construction with the dosage form (including sorption to container and leaching) safety of materials of construction, and performance (such as reproducibility of the dose delivery from the device when presented as part of the drug product).
3.2.P.2.5 微生物学的観点からみた特徴
必要に応じて、製剤の微生物学的観点からみた特徴(例えば非無菌製剤の微生物限度試験を行わないことの根拠、抗菌効果のある保存剤を含有する製剤にあっては、その選択理由及び効力を含む。)について考察する。無菌製剤の場合、微生物汚染を防ぐための容器及び施栓系の完全性を示す。
3.2.P.2.5 Microbiological Attributes
Where appropriate, the microbiological attributes of the dosage form should be discussed, including, for example, the rationale for not performing microbial limits testing for nonsterile products and the selection and effectiveness of preservative systems in products containing antimicrobial preservatives. For sterile products, the integrity of the container closure system to prevent microbial contamination should be addressed.
3.2.P.2.6 溶解液や使用時の容器/用具との適合性
製剤と溶解液や使用時の容器/用具との適合性(溶液中の原薬の沈殿、注射用容器への吸着、安定性等)について記述し、適切かつ必要な情報が添付文書等に記載できるようにする。
3.2.P.2.6 Compatibility
The compatibility of the drug product with reconstitution diluent(s) or dosage devices (e.g., precipitation of drug substance in solution, sorption on injection vessels, stability) should be addressed to provide appropriate and supportive information for the labeling.










