医薬審発第899号 CTD通知(別紙 3)
CTD-品質に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE
QUALITY – M4Q –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
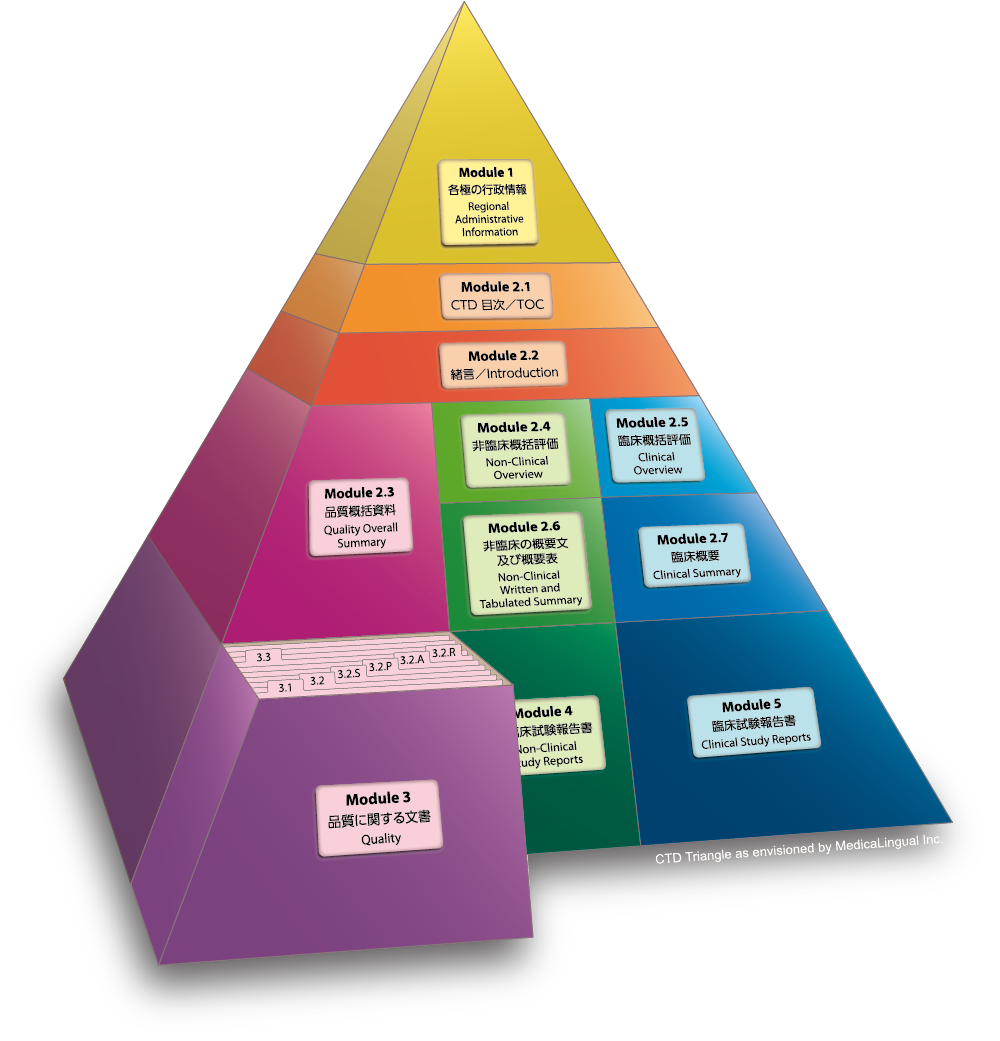
Module 3 品質に関する文書
3.2 データ
3.2.S 原薬
複数の原薬を含む製剤にあっては、各原薬ごとに3.2.S項の資料を作成する。
Module 3 QUALITY
3.2 Body of Data
3.2.S Drug Substance
For a drug product containing more than one drug substance, the information requested for part “S” should be provided in its entirety for each drug substance.
3.2.S.1 一般情報
3.2.S.1.1 名称
原薬の名称に関する事項を記述する。
記述する事項は、国際一般名(r-INN)、公定書収載名(もしあれば)、化学名、企業コード又は研究所コード、その他の一般名(BAN、USAN、JAN等の国ごとの名称等)、ケミカル・アブストラクト・サービス(CAS)登録番号等である。
3.2.S.1 General Information
3.2.S.1.1 Nomenclature
Information on the nomenclature of the drug substance should be provided. For example:
- Recommended International Nonproprietary Name (INN);
- Compendial name if relevant;
- Chemical name(s);
- Company or laboratory code;
- Other non-proprietary name(s), e.g., national name, United States Adopted Name
- (USAN), Japanese Accepted Name (JAN); British Approved Name (BAN), and
- Chemical Abstracts Service (CAS) registry number.
3.2.S.1.2 構造
新規化学薬品:
構造式(相対的及び絶対的立体化学を含む。)、分子式及び分子量を示す。
生物薬品:
適宜、糖鎖結合部位、その他翻訳後修飾を示したアミノ酸配列及び相対分子量を記載する。
3.2.S.1.2 Structure
NCE:
The structural formula, including relative and absolute stereochemistry, the molecular formula, and the relative molecular mass should be provided.
Biotech:
The schematic amino acid sequence indicating glycosylation sites or other posttranslational modifications and relative molecular mass should be provided, as appropriate.
3.2.S.1.3 一般特性
原薬の物理的化学的性質その他の適切な特性(生物薬品の場合には、生物活性を含む。)の一覧表を示す。
3.2.S.1.3 General Properties
A list should be provided of physicochemical and other relevant properties of the drug substance, including biological activity for Biotech.
Reference ICH Guidelines: Q6A and Q6B










