医薬審発第899号 CTD通知(別紙 3)
CTD-品質に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE
QUALITY – M4Q –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
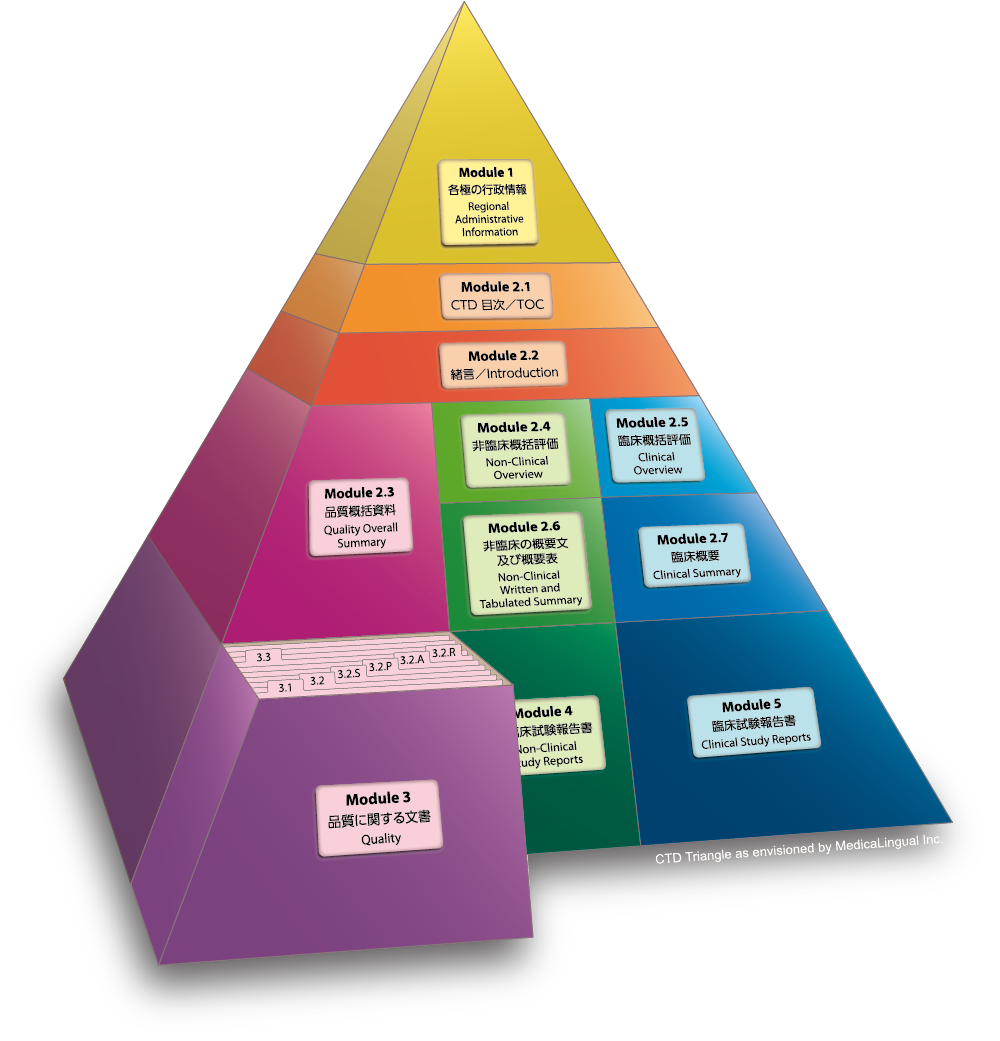
Module 3 品質に関する文書
3.2 データ
3.2.S 原薬
複数の原薬を含む製剤にあっては、各原薬ごとに3.2.S項の資料を作成する。
Module 3 QUALITY
3.2 Body of Data
3.2.S Drug Substance
For a drug product containing more than one drug substance, the information requested for part “S” should be provided in its entirety for each drug substance.
3.2.S.3 特性
3.2.S.3.1 構造その他の特性の解明
新規化学薬品:
合成経路、スペクトル分析結果等に基づいた構造決定の結果を示す。異性体存在の可能性、立体構造の決定、得られた結晶多形等についても記述する。
参照ICHガイドラインQ6A
生物薬品:
目的物質及び目的物質関連物質について、適宜、一次構造、二次構造及び高次構造、翻訳後の構造(糖結合形等)、生物活性、純度並びに免疫化学的性質を明らかにすること。
参照ICHガイドラインQ6B
3.2.S.3 Characterisation
3.2.S.3.1 Elucidation of Structure and other Characteristics
NCE:
Confirmation of structure based on e.g., synthetic route and spectral analyses should be provided. Information such as the potential for isomerism, the identification of stereochemistry, or the potential for forming polymorphs should also be included.
Reference ICH Guideline: Q6A
Biotech:
For desired product and product-related substances, details should be provided on primary, secondary and higher-order structure, post-translational forms (e.g., glycoforms), biological activity, purity, and immunochemical properties, when relevant.
Reference ICH Guideline: Q6B
3.2.S.3.2 不純物
不純物について記述する。
参照ICHガイドラインQ3A、Q3C、Q5C、Q6A及びQ6B
3.2.S.3.2 Impurities
Information on impurities should be provided.
Reference ICH Guidelines: Q3A, Q3C, Q5C, Q6A, and Q6B










