医薬審発第899号 CTD通知(別紙 3)
CTD-品質に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE
QUALITY – M4Q –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
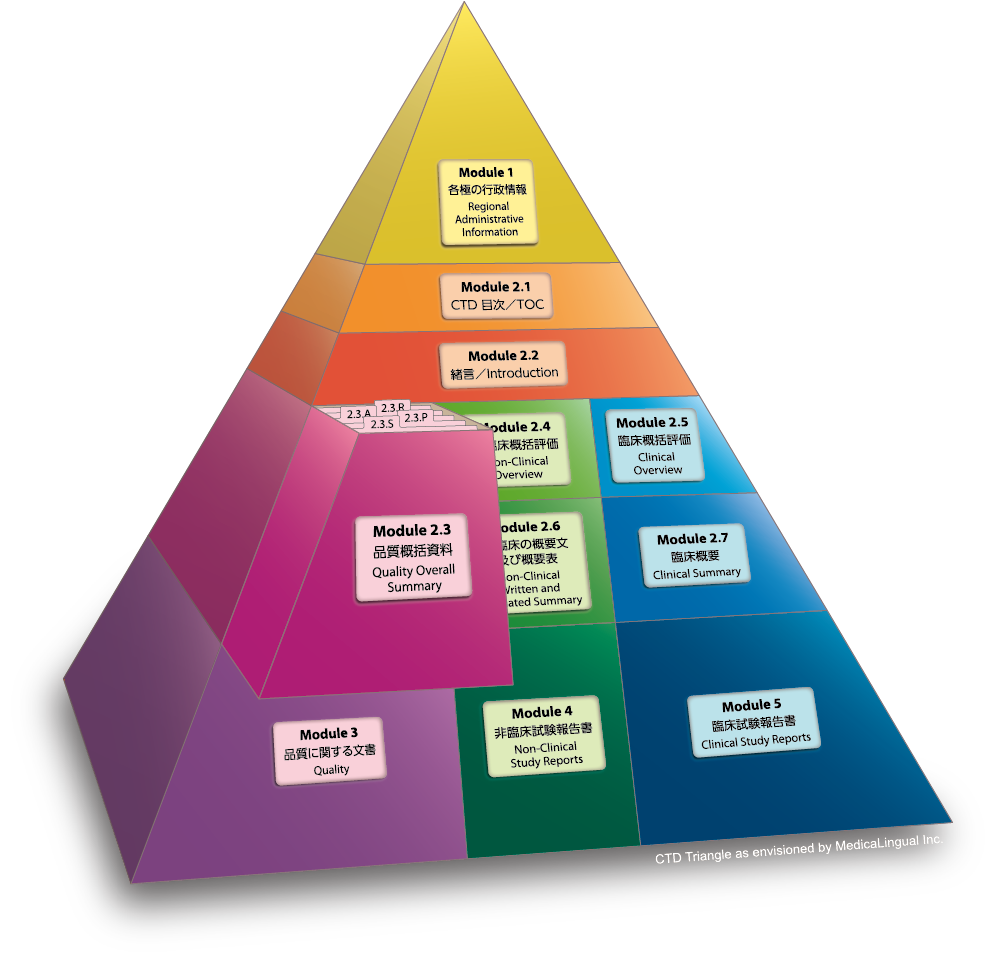
Module 2.3 品質に関する概括資料
2.3.A その他
2.3.A.1 製造施設及び設備
生物薬品:
3.2.A.1 に記載された施設に関する情報の要約を示す。
Module 2.3 QUALITY OVERALL SUMMARY
2.3.A Appendices
2.3.A.1 Facilities and Equipment
Biotech:
A summary of facility information described under 3.2.A.1 should be included.
2.3.A.2 外来性感染性物質の安全性評価
医薬品製造過程における内在性及び外来性感染性物質をコントロールする方策に関する考察を示す。
3.2.A.2 記載のウイルスクリアランス指数を一覧表として示す。
2.3.A.2 Adventitious Agents Safety Evaluation
A discussion on measures implemented to control endogenous and adventitious agents in production should be included.
A tabulated summary of the reduction factors for viral clearance from 3.2.A.2, should be provided.










