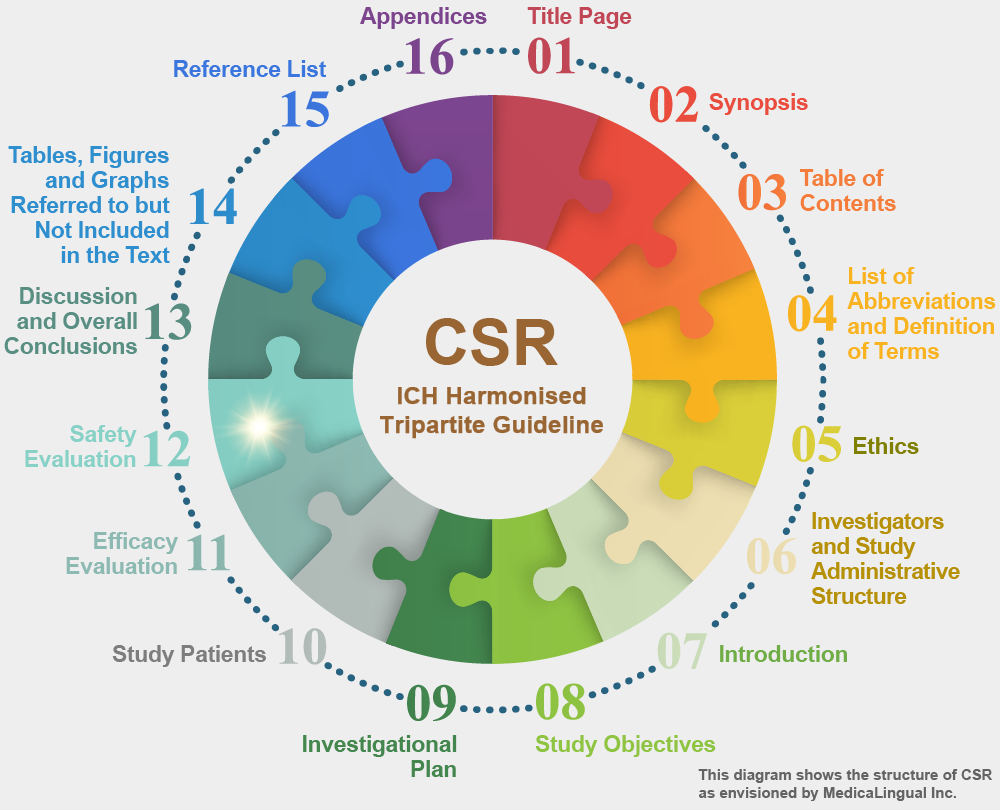
治験の統括報告書の構成と内容に関するガイドライン
平成8年5月1日 薬審第335号
各都道府県衛生主管部(局)長あて 厚生省薬務局審査課長通知
STRUCTURE AND CONTENT OF CLINICAL STUDY REPORTS
Recommended for Adoption at Step 4 of the ICH Process on 30 November 1995 by the ICH Steering Committee
12. 安全性の評価
12.2 有害事象
12.2.4 患者ごとの有害事象の一覧表
各患者ごとの全ての有害事象を,同一事象であっても発現ごとに,用語集に基づく用語と治験責任医師が用いたままの用語との双方を使って一覧表にし,付録16.2.7に添付すること。この一覧表は,治験責任医師及び治療群ごとに示し,以下のものを含めること:
-患者識別コード
-年齢,人種,性別,体重(適切であれば,身長)
-症例記録の所在(添付している場合)
-有害事象(用語集に基づく用語,報告書に用いられている用語)
-有害事象の持続期間
-重症度(例えば,軽度,中等度,高度)
-重篤度(重篤/重篤でない)
-処置(なし,用量減量,治療中止,特殊な治療の開始など)
-転帰(例えば,CIOMS 様式)
-因果関係の評価(例えば,関連性あり/関連性なし)。それがどのように決定されたかを表中又は他のどこかに記述すること。
-発現日,又は事象が発見された来院日
-治験薬の最終投与との関係における有害事象発現のタイミング(適切であれば)
-事象発現時に行われていた治験治療又は直前の試験治療
-事象発現時の治験薬の絶対量,mg/kg 又はmg/m2用量
-薬物濃度(わかっている場合)
-治験薬による治療の期間
-治験中の併用療法
12. SAFETY EVALUATION
12.2 ADVERSE EVENTS (AEs)
12.2.4 LISTING OF ADVERSE EVENTS BY PATIENT
All adverse events for each patient, including the same event on several occasions should be listed in appendix 16.2.7, giving both preferred term and the original term used by the investigator. The listing should be by investigator and by treatment group and should include:
– Patient identifier
– Age, race, sex, weight (height, if relevant)
– Location of CRFs, if provided
– The adverse event (preferred term, reported term)
– Duration of the adverse event
– Severity (e.g., mild, moderate, severe)
– Seriousness (serious/non-serious)
– Action taken (none, dose reduced, treatment stopped, specific treatment instituted etc.)
– Outcome (e.g., CIOMS format)
– Causality assessment (e.g., related/not related). How this was determined should be described in the table or elsewhere
– Date of onset or date of clinic visit at which the event was discovered
– Timing of onset of the adverse event in relation to last dose of test drug/investigational product (when applicable)
– Study treatment at time of event or most recent study treatment taken
– Test drug/investigational product dose in absolute amount, mg/kg or mg/m² at time of event
– Drug concentration (if known)
– Duration of test drug/investigational product treatment
– Concomitant treatment during study.
全ての略号や記号は,その一覧表の冒頭に,又はできれば各ページに説明すること。
Any abbreviations and codes should be clearly explained at the beginning of the listing or, preferably, on each page.










